Kunstbaarmoeder die werkt voor lam, ontwikkeld
Onderzoekers zijn er in geslaagd om lammeren ter wereld te laten komen die geheel zijn opgegroeid in een kunstbaarmoeder.
Binnen enkele jaren zullen ook onvruchtbare ouders, of een mannelijk homopaar, hun kinderen kunnen baren zonder lichaam van een moeder. Nu kunnen alleen hetero’s, of een lesbisch paar, kinderen krijgen.
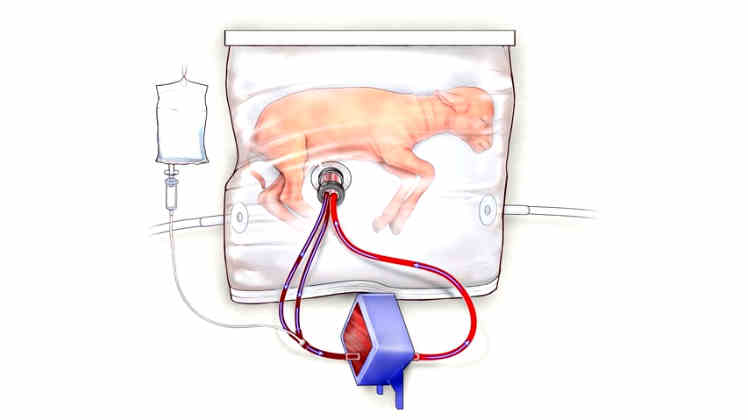
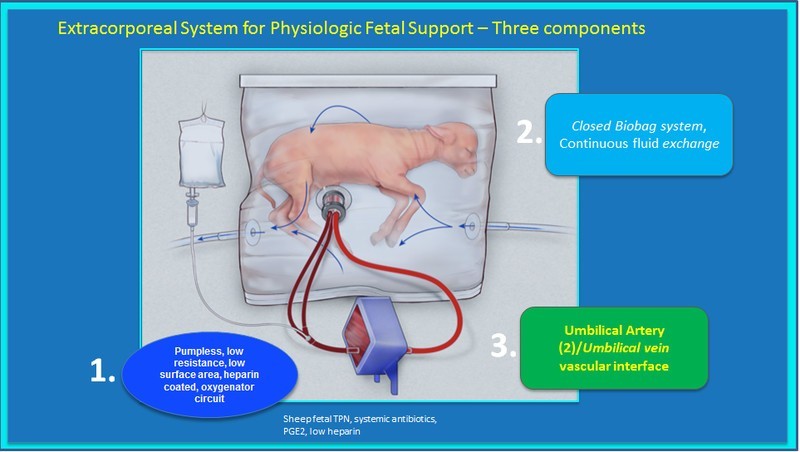
Biobag, een kunstbaarmoeder
Foetaal chirurg Alan Flake en enkele collega’s van het kinder ziekenhuis in Philadelphia, Pennsylvania, kweekten premature foetussen van schapen op in hun Biobag. Dat is een soort kunstmatige baarmoeder.
De Biobag is een soort doorzichtige zak. Binnen die zak groeit de foetus op. En wordt voorzien van voeding. Een door de groep ontwikkelde oxygenator ververst ook de zuurstof in het bloed van de foetus. Uniek aan het ontwerp is het ontbreken van een pomp. Deze functie wordt vervuld door het hartje van de foetus. Net zoals ook gebeurt in een echte baarmoeder. Dit kan, omdat de bloedsomloop in het ontwerp erg weinig frictie kent. Daardoor is het hart van het ongeboren dier voldoende.
Redden van de levens van ongeboren kinderen
De foetussen waren bij het overbrengen van de moeder naar de baarmoeder in ontwikkeling vergelijkbaar met menselijke foetussen van jonger dan 28 weken. Dat is ongeveer zes maanden. Op dit moment sterft meer dan driekwart van de foetussen van deze leeftijd als ze grootgebracht worden in een couveuse. De kinderen die het overleven, hebben in twintig tot dertig procent van de gevallen later in hun leven te kampen met ernstige gezondheidsproblemen. Dat komt, omdat hun organen zich niet goed hebben kunnen ontwikkelen. Deze kunstmatige baarmoeder kan veel mensenlevens redden. Ook voorkomen we zo ziekten in de toekomst. Dit bespaart veel leed, en ook veel medische zorgkosten.
Kunstmatige baarmoeder mogelijk?
Zowel voor het embryo als de foetus wordt het venster waarbinnen nog een natuurlijke moeder nodig is steeds kleiner: nu tussen de twee en 29 weken. Deze twee weken is alleen door regelgeving. De onderzoekers die er recent in slaagden om embryo’s twee weken lang in leven te houden, moesten van de wet op dat punt stoppen. In de middel verre toekomst is er daarom waarschijnlijk helemaal geen baarmoeder meer nodig. Voor een black hat biohacker, die aan ethiek geen boodschap heeft, is het dan mogelijk om mensen te kweken. Van eicel tot baby. Als een moderne Dr. Frankenstein, in een kelder. Hollywood scriptschrijvers en Q-anon gelovigen, let op.
Ethische dilemma’s van de kunstbaarmoeder
Er kleven aan deze techniek enkele ernstige dilemma’s. Zieke geesten zouden bijvoorbeeld zelf slaven kunnen kweken.
Of pedofielen. Zij kunnen kinderen kweken om als sekspartner te dienen. Of een leger van gehoorzame kindsoldaten. Echter: dit kan nu ook al en gebeurt al. Een vrouw of de vrouw van een stel kan zelf zwanger worden. Of een man alleen kan een vrouw ontvoeren en haar misbruiken. Denk aan het geval-Fritzl of Priklopil.
Maar toch. Deze techniek kan veel levens redden. Met goed medisch toezicht natuurlijk. Daarom denk ik dat dit per saldo goed gaat uitpakken.