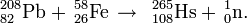Een serie artikelen over de verschillende elementen. De legoblokjes waarmee wijzelf, onze aarde en de materie van het universum is opgebouwd hebben allemaal hun eigen specifieke eigenschappen. In deze serie gaan we stap voor stap langs elk element en kijken we wat voor zinvolle zaken de wikipedia erover te zeggen heeft, met daarnaast een interessant filmpje van de universteit van Nottingham waarmee verschillende experimenten met het betreffende element worden gedaan.
Vandaag nummer 108 van de 118 elementen, Hassium (Hs).

Ontdekking
Hassium is een transuraan element, het is zelfs een transactinide. Het werd voor het eerst ontdekt in 1984 in het GSI (Gesellschaft für Schwerionenforschung) in Darmstadt in Duitsland. Het element is vernoemd naar de deelstaat Hessen.
In de oorspronkelijke experimenten werd een doelwit van lood-208 beschoten met versnelde ijzer-58-ionen en er ontstond een isotoop van hassium die een halveringstijd had van maar 1,5 milliseconden. Dit was te kort om de chemie van het element te kunnen onderzoeken.
Later, in 1996, bleek echter dat er ook isotopen bestaan die een wat langere adem hebben. Men was eigenlijk bezig om Copernicium (atoomnummer 112) te maken door lood met zinkionen te bombarderen. Het nieuwe element leefde bijzonder kort maar tussen de vervalproducten van 277Uub was een hassiumisotoop met een halveringstijd van wel 9 seconden. Men besloot daarom om een wat ander experiment op te zetten en hassiumchemie te gaan bedrijven.
Toepassingen
Er zijn van hassium geen toepassingen bekend.
Opmerkelijke eigenschappen
Omdat hassium onder osmium staat in het periodiek systeem, ligt het in de verwachting dat het tetraoxide HsO4 minstens zo vluchtig zal zijn als dat van de lichtere leden van groep 8 van het periodiek systeem. Men moet daar wel een beetje een slag om de arm houden, omdat het niet helemaal duidelijk is hoe zeer de gevolgen van de relativiteit de systematiek van het systeem verstoren. Met hogere atoomnummers wordt deze factor steeds belangrijker. Toch bleek uit berekeningen met behulp van dichtheidsfunctionaaltheorie dat hassium zich waarschijnlijk inderdaad als osmium zou gedragen.
In het experiment bombardeerde men een doelwit van curium met magnesium 26Mg5+ ionen. Er vonden twee reacties plaats:
- 248Cm(26Mg, 5n) 269Hs
- 248Cm(26Mg, 4n) 270Hs
269Hs vervalt via een α-proces naar 265Sg
270Hs vervalt via een α-proces naar 266Sg
De ontstane hassium atomen werden blootgesteld aan een gasstroom die helium en zuurstof bevatte en een ontstaan product (waarschijnlijk HsO4) weggevoerd een 10 m lange teflon buis in waarover een temperatuur gradiënt werd aangelegd. Het oxide kreeg daarbij de gelegenheid zich bij een bepaalde temperatuur, dat wil zeggen een bepaalde plek in de buis aan de wand te hechten (circa -44 °C). De hele buis was ingericht in een aantal zones waarin de vrijkomende straling gemeten kon worden. Op deze manier werden inderdaad een totaal van zeven HsO4 moleculen waargenomen.
Ref Nature 418, 859-861 (2002)
Verschijning
Van nature wordt hassium op aarde niet aangetroffen.