‘Ribosomen vormden begin van het leven’
In ribosomen, kleine celonderdelen, zijn kopieën aangetroffen van alle onderdelen van de machinerie des levens. Ribosomen zijn zeer complexe moleculen die uit zowel eiwitten als RNA bestaan. Hebben we nu de oorsprong van het leven echt te pakken?
RNA wereld
RNA is, anders dan DNA, weinig stabiel. RNA is echter wel in staat om als enzym te werken, terwijl DNA niet veel meer is dan een opslagmolecuul. Dit verklaart de populariteit van de RNA-wereld hypothese onder biologen. Deze zegt: voordat er DNA was, was er alleen RNA, dat zichzelf op de een of andere manier vermenigvuldigde en de omgeving manipuleerde.
Hoe RNA-gebaseerd leven er uitzag weten we niet, er bestaan anno nu voor zover we weten alleen nog maar RNA-virussen en viroïden, maar duidelijk is wel dat ribosomen hier een voorname rol in moeten hebben gespeeld.
Al eerder beschreef Visionair hoe een RNA-reactor een kraamkamer van ribosomen kan hebben gevormd. Een nieuwe ontdekking lost- waarschijnlijk- een volgend puzzelstukje op[1]. Ribosomen blijken namelijk een chemisch fossiel met zich mee te dragen, dat er op wijst dat ze in een grijs verleden zichzelf vermenigvuldigden, en hiermee de basis van het leven vormden.
Welke bestanddelen heeft de RNA-wereld?
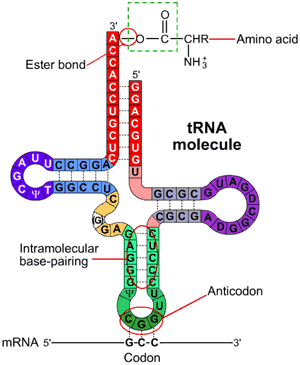
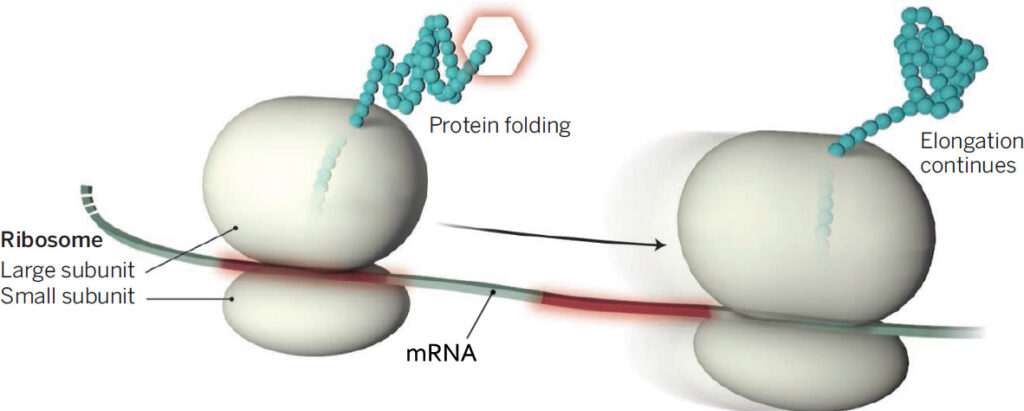
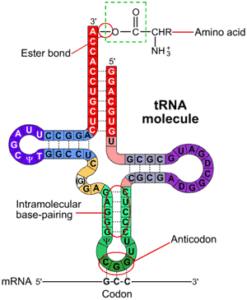
Als we DNA wegdenken, hoeft DNA niet meer vertaald te worden in m(essenger)-RNA. Ribosomen lezen het m-RNA en vertalen dit in een eiwit. In dit proces koppelen ze nieuwe aminozuren aan de groeiende eiwitketen. Ribosomen doen dit, doordat het bijpassende stukje t-RNA wordt aangetrokken door de code van drie RNA-“letters” en aankoppelt. Niet via een chemische binding, maar via tien maal zwakkere waterstofbruggen.
T-RNA bestaat uit een RNA-keten in de vorm van een kruis, met hieraan gekoppeld, een aminozuur. Voor elk aminozuur zijn er één of meer t-RNA’s. Dit aminozuur wordt losgehaald van het T-RNA en aan het groeiende eiwit gekoppeld. Dit proces stopt bij een stopcodon. Daaraan koppelt geen t-RNA, maar een blokkeermolecuul (release factor) dat het proces stopt, de twee delen van het ribosoom uit elkaar laat gaan en het ribosoom los laat koppelen van het messenger RNA.
Het speciale enzym aminoacyl tRNA synthetase, waarvan er per aminozuur een aparte variant is, koppelt dan weer weer los rondzwervende aminozuren aan het ‘lege’ t-RNA.
Gemiddeld kan een ribosoom 20-30 aminozuren per seconde aan elkaar plakken. Voor het produceren van een eiwit van 400 aminozuren groot, de gemiddelde grootte bij mensen, heeft een ribosoom dus tussen de vijftien en twintig seconden nodig. En bedenk ook dat er verschrikkelijk veel ribosomen zijn per cel, bij de mens tussen de 10 en 20 miljoen.
Hoe konden ribosomen zichzelf vermenigvuldigen?
Stel, ribosomen vormden de plek waar ooit alle genetische informatie werd opgeslagen. Dan moeten ribosomen zichzelf, direct of indirect, kunnen vermenigvuldigen. Ribosomen bestaan, zoals gezegd, uit eiwitten en RNA (in totaal rond de 4000-10.000 RNA-basen[2]). De eiwitten die deel uit maken van het ribosoom, moeten dan gebouwd worden. Deze moeten dus als hun RNA-blauwdruk, hun m-RNA, ergens opgeslagen staan.
Er bestaat nog geen DNA, dus moet dat opslaan in het ribosoom zijn gebeurd. Dit geldt ook voor de t-RNA’s. Zonder t-RNA’s, die aminozuren koppelen aan de m-RNA codes, werkt het ribosomale systeem niet. Ook de 20 t-RNA’s moeten dus terug te vinden zijn in het RNA van het ribosoom. Zo ook het enzym RNA-polymerase, noodzakelijk om een ribosoom te lezen en over te kopiëren.
Genetisch onderzoek: ribosomen als oeroude levensvorm
Om hun hypothese, dat het leven begon als ribosoom, te testen, moesten er dus sporen van deze dingen in het r(ibosomale)-RNA terug te vinden zijn. “Slachtoffer” werd de labmuis onder de bacteriën: E. coli. Van deze bacterie is het gehele genetische materiaal in kaart gebracht, inclusief dat van de ribosomen. De heersende hypothese is dat het RNA van het ribosoom maar één doel heeft: het ribosoom de juiste vorm laten houden. Dit bleek onzin: het RNA bevat extra informatie. Nader onderzoek wees uit dat er inderdaad sporen van alle oeroude t-RNA’s en omringende eiwitten te vinden zijn. Het t-RNA in de ribosomen bleek zich zelfs nog vrij goed in de juiste vorm te kunnen vouwen. Opmerkelijk, gezien de miljarden jaren dat het leven oud is.
Gevolgen
Nu de vermoedelijke voorloper van het eencellige leven is ontdekt, kunnen we om te beginnen op zoek gaan naar niet op DNA gebaseerde levensvormen. Mogelijk bestaan er meer op RNA gebaseerde levensvormen dan alleen de ontdekte RNA-virussen. Tot nu toe is er niet echt gericht naar gezocht: op RNA gebaseerde levensvormen kunnen niet met DNA-PCR-technieken worden gevonden.
Nu RNA erg belangrijk blijkt te zijn voor het ontstaan van leven, kunnen we op zoek naar plaatsen waar zich veel bouwstenen van RNA, ribonucleotides, vormen. Hier zal de kans op leven veel groter zijn.
Verder blijken ribosomen dus veel groter te zijn dan eigenlijk nodig. Synthetische levensvormen kunnen, blijkt dus, met veel kleinere, en dus zuinige, ribosomen toe, waardoor je een extreem groeikrachtige superbacterie, of ander organisme, kan kweken. Of, losse ribosomen kan gebruiken voor eiwitsynthese zonder een bacterie.
Een andere mogelijkheid is, dat op ribosomen gebaseerd leven zich in een andere richting heeft geëvolueerd dan als DNA-gebaseerd cellulair leven.
Bron
1. Meredith en Robert Root-Bernstein, The ribosome as a missing link in the evolution of life, Journal of Theoretical Biology, 2014
2. Ribosomal RNA sizes