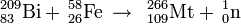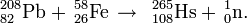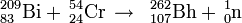Het periodiek systeem Livermorium (Lv)
Een serie artikelen over de verschillende elementen. De legoblokjes waarmee wijzelf, onze aarde en de materie van het universum is opgebouwd hebben allemaal hun eigen specifieke eigenschappen. In deze serie gaan we stap voor stap langs elk element en kijken we wat voor zinvolle zaken de wikipedia erover te zeggen heeft, met daarnaast een interessant filmpje van de universteit van Nottingham waarmee verschillende experimenten met het betreffende element worden gedaan.
Vandaag nummer 116 van de 118 elementen, Livermorium (Lv)

Livermorium (symbool: Lv) (eerder bekend onder de tijdelijke naam Ununhexium, met het symbool Uuh) is de naam van het scheikundig element 116.
De melding van de ontdekking van het element – zoals hieronder beschreven – is door het Lawrence Berkeley National Laboratory ingetrokken. Het vermoeden is dat de ontdekker, V. Ninov, die ook betrokken was bij de ontdekking van element 111 en 112, de data heeft gemanipuleerd. Omdat Livermorium (116) als vervalproduct van ununoctium (118) is ontdekt, is ook de plaats van dit element nu niet gevuld.
Element 118 werd in 1999 voor het eerst bereid door medewerkers van het Lawrence Berkeley Laboratory in Californië en de Oregon State University, onder leiding van V. Ninov, K.E. Gregorich en A. Ghiorso. Deze bereiding was gebaseerd op berekeningen van R. Smolanczuk, die aangaf dat deze fusie mogelijk was bij beschietingen onder zeer stringente condities. Het onderzoek naar het element werd daarop met succes voortgezet door het Gezamenlijk Instituut voor Kernonderzoek.
Naamgeving
Sinds 1 december 2011 was de IUPAC bezig met het goedkeuringsproces om het de naam livermorium te geven.[1] Tot dan toe werd het Latijnse telwoord voor dit element gehanteerd, namelijk ununhexium. Op 30 mei 2012 heeft IUPAC de naam livermorium goedgekeurd.[2][3]. De naam is afgeleid van het Lawrence Livermore National Laboratory, gevestigd in Livermore, Californië, Verenigde Staten.
Vorming
Het element werd gemaakt door curium te beschieten met calciumionen: