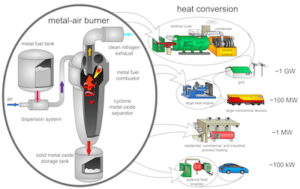
Natrium uit zout vervangt lithium – lithiumschaarste voorbij?
Lithium, dat geheel gevormd werd tijdens de eerste paar seconden dat het heelal bestond, wordt steeds schaarser. Maar we zwemmen letterlijk in natrium, uit keukenzout. Is dit de oplossing voor het steeds grotere tekort?
Licht en schaars metaal
Lithium is het lichtste metaal dat in dit universum bestaat. Een blokje van het metaal blijft op water drijven, terwijl het borrelend en fel sissend reageert met het water. Ook met de zuurstof in de lucht reageert het snel. Daarom moet je dit metaal onder olie bewaren.
Tot einde van vorige eeuw was lithium vooral bekend (in de vorm van lithium carbonaat) als geneesmiddel bij patiënten met een bipolaire stoornis. Tot de lithium-ion batterij uitgevonden werd. Het gevolg: de vraag naar het vrij zeldzame alkalimetaal explodeerde. En daarmee de prijs.
Nu is er een probleem. Makkelijk winbare lithium begint schaars te worden. Dat geldt ook voor kobalt, een onmisbaar onderdeel van lithium-ion batterijen. Dus als we elke aardbewoner van een oplaadbare stekkerauto willen voorzien, moeten we een nieuwe bron van deze metalen zien te vinden. Of… een vervanger.
Natrium vervangt lithium
In een batterij of accu springen elektronen over naar een atoom, waaraan ze sterker binden. Als bijvoorbeeld een elektron overspringt van een lithiumatoom naar een chlooratoom, levert dit ongeveer twee volt op. 3,15 volt (chloor) min 0,98 volt (lithium) geeft 2,17 volt spanning. We kunnen die elektronen weer terug geven aan lithium, door er 2,17 of meer volt spanning op te zetten. Zo laad je de accu weer op. Chloor is niet zo praktisch. Het is immers een gas. Daarom werken de meeste lithium ion accu’s met vaste stoffen, zoals kobaltoxide.
– Werkingsprincipe lithium-ion batterij
Als we een stapje omlaag gaan in het periodiek systeem, staat direct onder lithium, het metaal natrium. Weliswaar is natrium veel zwaarder dan lithium, maar chemisch gezien lijken de twee metalen erg op elkaar. Het goede nieuws is: we zwemmen in dit metaal. Letterlijk. Want elke liter zeewater bevat twaalf gram puur natrium. Het zout in onze keuken zelfs 2/5 deel.

Grotere massa niet zo erg
Nadeel is, dat een kilo natrium meer dan drie keer zo weinig atomen bevat als een kilo lithium. Dus, in theorie, kan er veel minder energie uitgehaald kan worden. Gelukkig blijkt dit in de praktijk mee te vallen. De anionen, dat wil zeggen: de negatieve ionen waarmee lithium en natrium zijn verbonden, zijn dezelfde. En deze anionen zijn zwaarder dan het lithium, of natrium. In totaal maakt het natrium maar hooguit 20 procent uit van de totale massa van het ontwerp. De elektrolyt (dat is het medium waar de ionen door heen reizen van de ene pool naar de andere pool), het materiaal van de polen en de negatieve ionen (anionen), zijn qua gewicht samen belangrijker.
Ook is natrium nog actiever dan lithium, waardoor 0,93 volt al genoeg is om een elektron los te wrikken. Bij lithium is veel meer nodig: 0,98 volt[1]. Dit maakt veel goed. Dit verhoogt namelijk de energie van de reactie. Natrium batterijen zijn ook veiliger dan die van lithium, kunnen tegen veel lagere en hogere temperaturen en geven hun vermogen veel sneller af. Waarom dan nog lithium, en geen natrium, in onze smartphones en laptops?
Voornaamste technische bottleneck nu opgelost
Een probleem is dat natriumatomen (en dus natriumionen) veel groter, en dus logger, zijn dan lithiumatomen. En dus moeilijker door de accu kunnen reizen. Het materiaal van de elektrode moet dus een soort “snelwegen” voor natriumionen bevatten. Twee ontdekkingen, in 2014 door een groep Japanners en in 2020 door een Zwitsers team, maken dit nu mogelijk. Beide teams hielden zich bezig met natrium-hydroboraten als elektrolyt. De Japanners slaagden er in 2014 in, dit goedje zo te verbeteren dat het Na+-ionen soepel door laat. [2] Helaas werkte dit mengsel alleen bij een zeer hete 250 graden C (523 K). Wat minder handig op je schoot, natuurlijk. Tenzij je Chuck Norris heet.
Gelukkig slaagde het Zwitserse team er in om het bereik op te rekken tot 100-700 kelvin. Dat wil zeggen, deze accu werkt zowel op de ijskoude grootste maan van Jupiter, Ganymedes, als op Mercurius. Dag en nacht. De temperatuur in huis is hiermee zeker geen probleem [3]. Nog meer goed nieuws is dat zowel boor, waterstof als natrium op aarde niet schaars zijn. Dus hebben we eenmaal een goede manier , dan kunnen we deze accu’s voor bijna niets maken.
Op dit moment werken twee Zwitserse instituten samen om een prototype van deze accu te ontwikkelen. Gaat dit lukken? En vinden zij en hun collega-onderzoekers een goedkoop productieproces uit? Dan betekent dit een grote doorbraak voor de goedkope opslag van zonne- en windenergie.
Bronnen
1. Elektronegativiteiten (tabel) – Wikipedia
2. Terrence A., Udovic et al., Sodium superionic conduction in Na2B12H12, Chemical Communications, 2014, DOI: 10.1039/c3cc49805k
3. Matteo Brighi et al., Closo-Hydroborate Sodium Salts as an Emerging Class of Room-Temperature Solid Electrolytes, Cell Reports Physical Science, 2020, DOI: 10.1016/j.xcrp.2020.100217



 . m.a.w. kooldioxide en water worden verbruikt en er vormt zich ethanol en loog.
. m.a.w. kooldioxide en water worden verbruikt en er vormt zich ethanol en loog.


![Vlammen van ijzer, aluminium, methaan en een ijzer-boormengsel. Bron: [1]](https://www.visionair.nl/wp-content/uploads/2015/12/couldmetalpa.jpg)
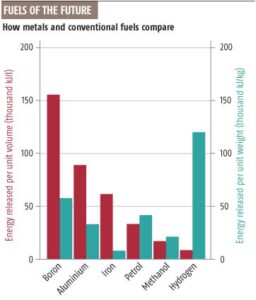
![Vlammen van metaalpoeder: ijzer, aluminium, methaan en een ijzer-boormengsel. Bron: [1]](https://www.visionair.nl/wp-content/uploads/2015/12/couldmetalpa-300x106.jpg)