Medische startup Libella start eerste proefbehandeling voor levensverlenging
Heb je een miljoen euro op de plank liggen en wil je graag medisch proefkonijn worden? Maak dan een reis naar het Zuid-Amerikaanse land Colombia voor een reële kans op maar liefst twintig jaar langer leven.
Medische thriller
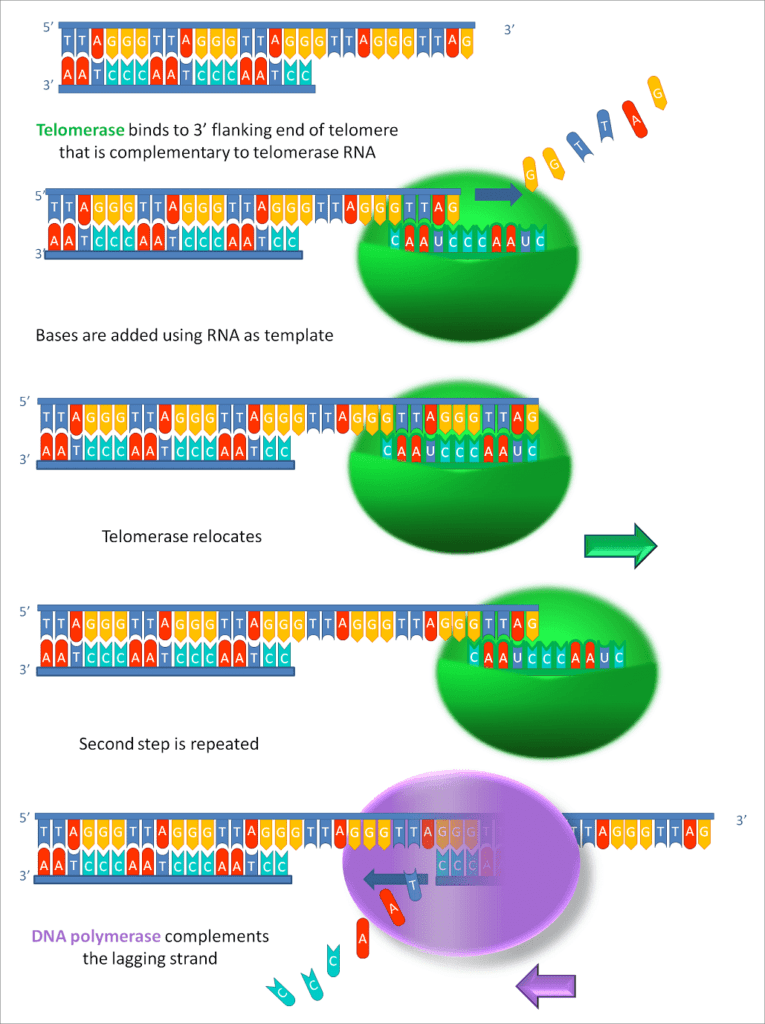
Het script had zo uit een medische thriller van Robin Cook kunnen komen. Libella Gene Therapeutics, LLC (“Libella”) kondigt een betaalde deelname aan aan een klinische proef in Colombia. De behandeling is goedgekeurd door de IRB, de Amerikaanse institutionele beoordelingsraad, in dit geval voor gentherapie. Deze gentherapie komt neer op het kunstmatig verlengen van telomeren, de uiteinden van chromosomen. Bij elke celdeling wordt het telomeer verkort. Als het telomeer korter dan de kritische lengte wordt, stopt de celdeling. Volgens sommige geriaters zouden cellen uit hun senescente (verouderde) toestand kunnen worden gehaald door hun telomeren kunstmatig te verlengen. De resultane bij dierproeven zijn wisselend. Bij sommige diersoorten leidt het verlengen van telomeren inderdaad tot levensverlenging. Inderdaad blijken menselijke cellen verjongd te worden als hun telomeren kunstmatig worden verlengd, althans, in vitro. Bij muizen leidt de verlenging van telomeren inderdaad tot een langere levensduur, echter, mensen zijn geen muizen.
Telomerase
Proefleider is de in de VS bekende dr. Bill Andrews, een wetenschapper die zijn hele leven heeft geprobeerd verouderingsprocessen te remmen en om te keren. Hij was onder meer de onderzoeksleider van Geron, het Amerikaanse bedrijf dat er in staagde de RNA-component en de eiwit-component van het enzym telomerase te produceren. Telomerase is het enzym dat telomeren verlengt. Hij is op de Amerikaanse TV te zien geweest in Popular Science, The Today Show en in talloze documentaires over levensverlenging, waaronder de documentaire The Immortalists.
Volgens het participatiemodel van Libella worden proefpersonen ingeschreven in hun land van herkomst na betaling van 1 miljoen Amerikaanse dollar. Deelnemers zullen naar Colombia reizen om hun geïnformeerde toestemming te ondertekenen en de Libella-gentherapie te ontvangen in een strikt gecontroleerde ziekenhuisomgeving.
Traditioneel wordt veroudering gezien als een natuurlijk proces. Deze zienswijze is veranderd en wetenschappers zijn nu van mening dat veroudering als een ziekte moet worden gezien. Het onderzoek op dit gebied heeft geleid tot de overtuiging dat een van de belangrijkste oorzaken van veroudering bij mensen de verkorting van onze telomeren is.
Telomeerverlenging als middel om veroudering te stoppen
Telomeren zijn de biologische klok van het lichaam. Telkens wanneer een cel zich deelt, worden telomeren korter en worden onze cellen minder efficiënt in het opnieuw delen. Dit is, stelt de telomeer-verouderingstheorie, de reden waarom we ouder worden. Een aanzienlijk aantal wetenschappelijke peer-reviewed studies hebben dit bevestigd. Meerdere van deze onderzoeken hebben aangetoond dat menselijke cellen kunnen worden verjongd door telomeren te verlengen.
Bill Andrews, Ph.D., de wetenschappelijke directeur van Libella, heeft een gentherapie ontwikkeld die bedoeld is om telomeren te verlengen. Dr. Andrew’s gentherapiesysteem is aangetoond als veilig met minimale bijwerkingen in ongeveer 200 klinische onderzoeken. Dr. Andrews leidde het onderzoek bij Geron Corporation meer dan 20 jaar geleden dat aanvankelijk menselijke telomerase ontdekte en deel uitmaakte van het team dat de eerste experimenten leidde met betrekking tot telomerase-inductie en kanker.
Bij muizen en menselijke cellen werkt telomeertherapie, maar…
Telomerase-gentherapie bij muizen vertraagt ​​veroudering en verhoogt de levensduur aanzienlijk, blijkt uit onderzoek. De klinische proef van Libella omvat een nieuwe gentherapie met behulp van een gepatenteerd AAV Reverse (hTERT) transcriptase-enzym en heeft als doel telomeren te verlengen. Libella gelooft dat verlenging van telomeren de sleutel is tot het behandelen en mogelijk genezen van veroudering. Echter, muizen zijn geen mensen.
De klinische proef van Libella is gepubliceerd in de database met klinische gegevens van de National Library of Medicine (NLM) van de Verenigde Staten. Libella is ’s werelds eerste en enige bedrijf voor gentherapie met een klinische studie gepubliceerd op clinicaltrials.gov die ernaar streeft de veroudering te keren.
Minder bureaucratie
Over waarom ze besloten om hun project buiten de Verenigde Staten uit te voeren, zei Dr. Jeff Mathis, de president van Libella: “Traditionele klinische proeven in de VS kunnen jaren en miljoenen, of zelfs miljarden dollars vergen. Het onderzoek en de technieken waarvan bewezen is dat ze werken, zijn nu klaar. We geloven dat we in Colombia sneller en goedkoper de wetenschappers, de technologie, de artsen en de laboratoriumpartners voor deze klinische proefneming kunnen verzamelen.”
Zin of onzin?
Redelijke mensen leggen zich neer bij onze beperkte levensduur. Echter, de mensheid is niet verder gekomen door redelijke mensen. Het lijkt een uitgesproken dom idee om je leven in de waagschaal te stellen, plus een miljoen dollar, voor deze onbewezen behandeling. Aan de andere kant: de therapie werkt bij menselijke cellen in het laboratorium en bij muizen. Zeker als je aan een tot nu toe ongeneeslijke ouderdomsziekte als de ziekte van Alzheimer leidt, is het denk ik de moeite waard om deel te nemen aan deze proef. Op zich is de wetenschappelijke basis redelijk solide. Tienduizenden zijn bereid om hun leven in de waagschaal te stellen voor volk en vaderland, in een oorlog. Is het niet veel nobeler om je leven te riskeren om de mensheid verder te helpen?